Röntgenspektrum
Charakteristische Röntgenstrahlung
In einer Röntgenröhre entstehen stets zwei unterschiedliche Röntgenstrahlungsarten. Die vom Material der Anode abhängige charakteristische Röntgenstrahlung und die Röntgenbremsstrahlung.
Zusammen bilden sie das Röntgenspektrum. Im heutigen Beitrag beschäftigen wir uns etwas näher mit der charakteristische Röntgenstrahlung.
Die charakteristische Röntgenstrahlung ist ein Linienspektrum von Röntgenstrahlung, welches bei Übergängen zwischen Energieniveaus der inneren Elektronenhülle entsteht und für das jeweilige Element kennzeichnend ist. Sie wurde durch Charles Glover Barkla entdeckt, der dafür 1917 den Nobelpreis für Physik erhielt.
Entstehung
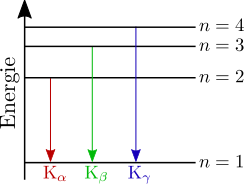
zugehörigen Energieniveaus
Die charakteristischen Linien des Röntgenspektrums (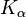 ,
, 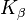 ,…) entstehen im Bild des bohrschen Atommodells wie folgt:
,…) entstehen im Bild des bohrschen Atommodells wie folgt:
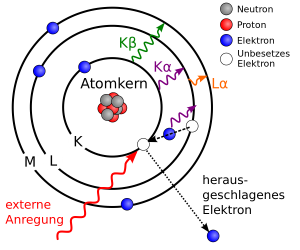
- Ein freies, energiereiches Elektron schlägt ein gebundenes Elektron aus einer inneren Schale seines Atoms heraus. Dabei muss auf das gestoßene Elektron mindestens die Energie übertragen werden, die zur Anregung auf eine noch unbesetzte Schale nötig ist. Meist ist sie größer als die vorherige Bindungsenergie des Elektrons und das Atom wird ionisiert.
- Die entstandene Lücke wird durch ein Elektron einer äußeren Schale geschlossen. Da die Elektronen auf den äußeren Schalen höhere Energien aufweisen, müssen sie die Differenz der Energie bei ihrem Wechsel auf eine weiter innen gelegene Schale abgeben.
- Dies geschieht wegen der typischerweise in der Größenordnung 1–100 keV liegenden Energiedifferenz der Elektronenhülle in den beiden Zuständen (fehlendes Elektron in innerer Schale und in äußerer Schale) in Form von Röntgenstrahlung. Die Strahlung besitzt also die Energiedifferenz zwischen höherer (z. B. L-) und niedrigerer (z. B. K-)Schale. Da diese Energiedifferenz elementspezifisch ist, nennt man die Röntgenstrahlung „charakteristische Röntgenstrahlung“.
Die Wellenlänge und damit die Energie der emittierten Strahlung kann mit dem moseleyschen Gesetz berechnet werden.
Bezeichnung der Spektrallinien
Zur Bezeichnung der Röntgenlinien gibt man zunächst die innere Schale an, in die das Elektron bei der Emission übergegangen ist, z. B. K, L, M, usw.
Ein griechischer Buchstabe als Index gibt die äußere Schale an, aus der das Elektron kam. Bei der K-Serie bedeutet 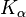 , dass die äußere Schale die nächsthöhere, also die L-Schale, ist; bei
, dass die äußere Schale die nächsthöhere, also die L-Schale, ist; bei  , ist es die M-Schale; usw.
, ist es die M-Schale; usw.
Bei den L- und M-Serien sowie bei Atomen mit höherer Ordnungszahl ist diese Zuordnung nicht mehr so eindeutig. Hier spielt die Feinstrukturaufspaltung eine Rolle.
Zusätzlich zum griechischen Index wird dann noch ein numerischer Index zur Unterscheidung der Linien verwendet.
Auftreten mehrerer Spektrallinien nach einer Elektronenanregung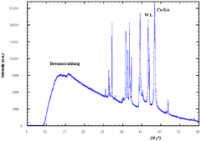
Abb. links: - Spektrallinien von Röntgenstrahlung einer Kupferanode. Die horizontale Achse zeigt den Ablenkwinkel nach Bragg-Reflexion an einem LiF-Kristall
Atome mit höherer Ordnungszahl haben mehrere äußere Schalen, die zur Auffüllung des Lochs in der inneren Schale ein Elektron liefern können.
Auch kann das Loch in verschiedenen inneren Schalen entstehen. Dementsprechend können diese Atome auch Röntgenstrahlen unterschiedlicher Energie aussenden.
- Nachdem ein Elektron auf die K-Schale gefallen ist, ist wiederum z. B. die L-Schale unterbesetzt. Ein weiteres Elektron aus einer noch höheren Schale fällt herunter unter Aussendung eines weiteren Photons. Dieses zweite Photon ist von niedriger Energie und trägt in diesem Beispiel zur L-Linie bei.
- Neben der Röntgenemission bildet – besonders bei leichten Atomen mit Ordnungszahlen
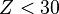 – die Übertragung der Energie auf weiter außen gelegene Elektronen eine andere Möglichkeit für den Ausgleich der Energiedifferenz .
– die Übertragung der Energie auf weiter außen gelegene Elektronen eine andere Möglichkeit für den Ausgleich der Energiedifferenz .
Nebenstehend eine interaktive Animationen von www.planet-schule.de/ zur Veranschaulichung der Bremsstrahlung: (Klick auf Bild)
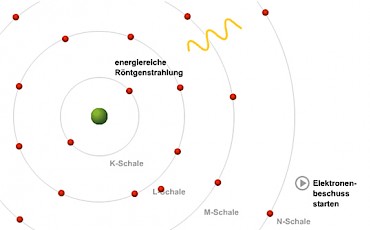
Einige der beschleunigten Elektronen rasen aber ungebremst direkt in ein Elektron des Anodenmaterials. Sie reißen es komplett aus seinem Atom heraus oder heben es zumindest auf eine Bahn, die energetisch gesehen deutlich höher liegt.
Dabei entsteht ein freier Platz auf dessen Ursprungsbahn - und der wird im Bruchteil einer Sekunde durch ein nachstürzendes Elektron besetzt.
Dieses nachrückende Elektron muss von einer energetisch höheren Bahn gekommen sein, sonst hätte es ja den neuen Platz gar nicht wählen können. Also wird eine große Portion Energie frei - sie verlässt als charakteristische Röntgenstrahlung die Röhre.
Erzeugung in der Röntgenröhre
In einer Röntgenröhre treffen energiereiche Elektronen auf eine Anode, wo diese einerseits charakteristische Röntgenstrahlung erzeugen, andererseits aber auchBremsstrahlung erzeugt wird. Die Linien der charakteristischen Röntgenstrahlung erscheinen in der graphischen Auftragung des Spektrums als hohe Erhebungen, während der Untergrund von der Bremsstrahlung gebildet wird.
Weiterlesen: - Die Röntgenbremsstrahlung
Quellen:
- Die obige Beschreibung sowie die Bilder stammen aus dem Wikipedia-Artikel “Charakteristische Röntgenstrahlung“, lizenziert gemäß CC-BY-SA. Eine vollständige Liste der Autoren befindet sich hier.
- www.planet-schule.de/








Kommentieren